Riportiamo tradotto lo studio “Antitumor Research on Artemisinin and Its Bioactive Derivatives” sulla capacità antitumorale di Artemisia Annua condotto e pubblicato dai team: 1State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming, 650201 China 2University of the Chinese Academy of Sciences, Beijing, 100049 China 3Yunnan Key Laboratory of Natural Medicinal Chemistry, Kunming, 650201 Yunnan China
Abstract
Il cancro è la principale causa di morte umana che minaccia seriamente la vita umana. È stato scoperto il farmaco antimalarico artemisinina e suoi derivati con notevoli proprietà antitumorali. Allo stesso tempo, è stata scoperta una varietà di composti correlati all’artemisinina selettivi per il bersaglio con alta efficienza.
Molte ricerche hanno indicato che i composti correlati all’artemisinina hanno effetti citotossici contro una varietà di cellule tumorali attraverso effetti pleiotropici, tra cui l’inibizione della proliferazione delle cellule tumorali, la promozione dell’apoptosi, l’induzione dell’arresto del ciclo cellulare, l’interruzione dell’invasione del cancro e delle metastasi, la prevenzione dell’angiogenesi, la mediazione del tumore- vie di segnalazione correlate e regolazione del microambiente tumorale.
Ancora più importante, le artemisinine hanno dimostrato effetti collaterali minori sulle cellule normali e hanno manifestato la capacità di superare la multi-resistenza ai farmaci che è ampiamente osservata nei pazienti con cancro. Pertanto, negli ultimi 5 anni ci siamo concentrati sui nuovi progressi e sullo sviluppo dell’artemisinina e dei suoi derivati come potenziali agenti antitumorali. La nostra speranza è che questa recensione possa essere utile per ulteriori esplorazioni di nuovi agenti antitumorali correlati all’artemisinina.

Introduzione
Il cancro è attualmente un problema di salute pubblica mondiale, che è, statisticamente, valutato come la principale causa di morte.
Le terapie antitumorali convenzionali consistenti in chemioterapia, chirurgia e radioterapia possono avere un’efficacia limitata, specialmente con il problema della resistenza ai farmaci [1]. Nonostante molti progressi significativi, il cancro è ancora una delle principali malattie che causa più di 8 milioni di morti ogni anno, ovvero circa il 15% di tutti i decessi umani nel mondo. Inoltre, i dati dell’OMS suggeriscono che 22 milioni di persone potrebbero sviluppare il cancro ogni anno entro i prossimi due decenni, mentre si prevede che i decessi per cancro saliranno a 13 milioni all’anno [2]. Tuttavia, con l’attuale efficacia chemioterapica contro il carcinoma ancora insoddisfacente, la scoperta di farmaci antitumorali potenti, sicuri e selettivi potrebbe causare un enorme interesse scientifico e commerciale da parte di molti ricercatori accademici.
La Medicina Tradizionale Cinese (MTC) e i relativi principi attivi naturali forniscono ricche risorse per lo sviluppo della medicina moderna. Ad esempio, l’artemisinina (ART), un lattone sesquiterpenico che porta un raggruppamento di perossido, è stata isolata dal farmacista cinese Youyou Tu et al. dalla foglia dell’erba Artemisia annua L. (assenzio dolce). In quanto farmaco di prima linea per il trattamento della malaria umana, l’artemisinina e i suoi derivati (Fig. 1) è stato riconosciuto come il trattamento più potente al mondo per la malaria.
Con l’ulteriore sviluppo dell’artemisinina e dei suoi derivati, gli studi hanno scoperto che le artemisinine hanno anche un’attività antitumorale desiderabile nel trattamento del cancro umano. Inoltre, i derivati dell’artemisinina, come la diidroartemisinina (DHA), l’artemetere (ATM), l’arteetere, l’artemisone e l’artesunato (AS), sembrano essere più potenti dell’artemisinina. Tuttavia, i meccanismi di azione sono delucidati in modo incompleto. Sembra che la scissione mediata dal ferro del ponte endoperossido svolga un ruolo fondamentale nel raggiungimento delle loro proprietà anti-cancro. Molte ricerche hanno evidenziato che le cellule tumorali contengono significativamente più ferro libero intracellulare rispetto alle cellule normali, mentre l’artemisinina contiene una frazione endoperossido può reagire con il ferro per formare radicali liberi citotossici [3].
È stato dimostrato che l’artemisinina ei suoi analoghi causano selettivamente l’apoptosi in più linee cellulari tumorali [4-11]. Inoltre, è stato dimostrato che i composti correlati all’artemisinina possiedono una quantità di proprietà antitumorali, come la soppressione della proliferazione cellulare, l’induzione della risposta apoptotica, l’arresto del ciclo cellulare del tumore, l’inibizione dell’invasione e delle metastasi delle cellule, la prevenzione dell’angiogenesi, l’alterazione delle reazioni di danno ossidativo, l’interruzione del cancro via di segnalazione e regolazione del microambiente tumorale [12-25]. Queste proprietà fanno sì che i composti correlati all’artemisinina diventino una serie di interessanti farmaci chemioterapici per il cancro.

Negli ultimi anni, le ricerche stanno gradualmente riposizionando l’artemisinina ei suoi analoghi come promettenti agenti antitumorali. Un numero crescente di ricerche ha riportato le eccellenti prestazioni dell’artemisinina e dei suoi derivati nella lotta contro vari tipi di linee cellulari tumorali e la loro prospettiva di applicazione clinica si è dimostrata ampia. Sono state pubblicate alcune buone recensioni [26-30]. Nella presente revisione, riassumiamo alcune delle questioni chiave nello sviluppo dell’artemisinina e dei suoi derivati come agenti antitumorali evidenziati da oltre 150 articoli su questo argomento pubblicati negli ultimi 5 anni.
Prendendo in considerazione le attività, i meccanismi, i benefici e i limiti delle artemisinine correlate agli antitumorali, forniamo uno spettacolo significativo per lo sviluppo attuale e futuro in questo promettente campo della scoperta di farmaci antitumorali.
Attività antitumorale dell’artemisinina
Negli ultimi 5 anni, numerosi nuovi studi hanno dimostrato che l’artemisinina ei suoi derivati possono uccidere selettivamente varie cellule tumorali, tra cui la leucemia [31-33], glioma cerebrale [34], cancro del fegato [35, 36], cancro gastrico [37, 38], cancro al seno [11, 39-41], cancro ai polmoni [42-44], cancro al colon [45, 46], linfoma a cellule B [15, 47, 48], cancro cervicale [49, 50], testa e carcinoma del collo [51], cancro della cistifellea [52], cancro rinofaringeo [53], osteosarcoma [54], cellule del cancro esofageo [55], rabdomiosarcoma [56], cellule di schwannoma [57], cancro del pancreas [58], cancro dell’ovaio [21], melanoma [59] e carcinoma della prostata [16, 60]. Inoltre, le artemisinine non hanno resistenza crociata con i farmaci terapeutici tradizionali e possono invertire la resistenza multi-farmaco delle cellule tumorali [61]. In termini di proprietà farmacocinetiche, i composti correlati all’artemisinina hanno le seguenti caratteristiche: rapido assorbimento, ampia distribuzione e rapida escrezione. Pertanto, la ricerca sulle attività antitumorali dell’artemisinina e dei suoi derivati potrebbe rappresentare un inizio promettente per aprire una nuova strada per il trattamento del cancro.
All’inizio degli anni ’90, i ricercatori cinesi hanno riferito per la prima volta che l’artemisinina ha un’attività inibitoria sui leucociti del sangue periferico 3H-TdR dei pazienti leucemici, in modo dipendente dalla concentrazione. Da allora, un numero crescente di letterature ha dimostrato i potenziali anti-leucemici delle artemisinine, descritti in dettaglio nella Tabella 1.
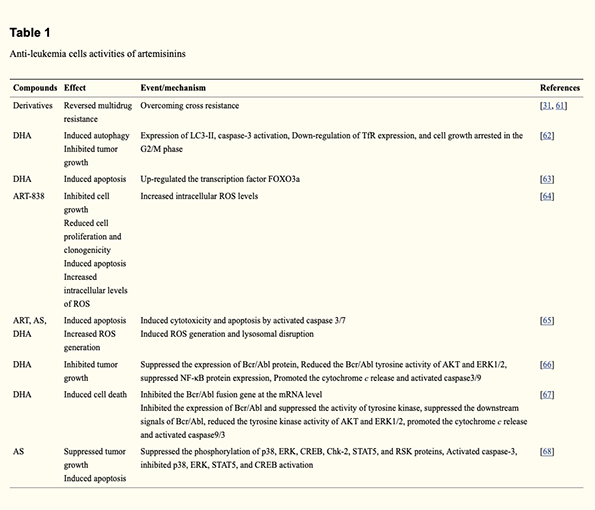
Come illustrato nella Tabella 1, ART, DHA e AS hanno ricevuto maggiore attenzione nel trattamento della leucemia negli ultimi 5 anni [69-73]. Per eludere il loro problema esistente, sono stati sintetizzati alcuni nuovi composti derivati dall’artemisinina. Questi nuovi composti, inclusi gli omodimeri dell’acido artesunic [32], gli ibridi 1,2,4-triossano-ferrocene [31] e dimeri e trimmer derivati dall’artemisinina [74], hanno la capacità di superare la multiresistenza ai farmaci. Dopo le combinazioni di artemisinina e alcuni derivati dell’acido colico, i ricercatori hanno scoperto che gli ibridi hanno mostrato prestazioni promettenti sia nella lotta contro le cellule CCRF-CEM sensibili della leucemia umana che contro le cellule leucemiche umane CEM / ADR5000 multiresistenti. I valori IC50 dei composti sono compresi tra 0,019 e 0,192 μM contro le cellule CCRF-CEM e tra 0,345 e 7,159 μM contro le cellule CEM / ADR5000, rispettivamente [75]. Inoltre, è stato dimostrato che l’ibrido ammidico è il composto più potente, il che può aiutarci a progettare nuovi ibridi a base di artemisinina utilizzando il legame amminico come parte del linker. Un’altra strategia di modifica delle artemisinine consiste nello sviluppo di loro derivati dimeri. Utilizzando calconi sostituiti come linker, Rashmi Gaur et al. ha sintetizzato una serie di dimeri derivati dall’artemisinina con notevole attività anti-leucemica [76].
Attività antitumorale dell’artemisinina sul cancro al seno
Recenti ricerche sull’attività antitumorale delle artemisinine sul cancro al seno si concentrano principalmente sulle artemisinine nanoliposomiali [11, 39, 77-79]. L’utilizzo di un trasportatore di nanoparticelle per somministrare farmaci è un buon modo per migliorare la biodisponibilità e le proprietà farmacocinetiche dei farmaci. Tra la moltitudine di sistemi di nanoparticelle, le nanoparticelle liposomiali rappresentano una classe di veicoli di rilascio meglio sviluppati [77]. Studi cumulativi hanno rivelato che la formulazione nanoliposomiale di artemisinine ha aumentato sostanzialmente gli effetti antitumorali dei composti correlati all’artemisinina. Nonostante le artemisinine nanoliposomiali, le ricerche si concentrano anche sullo sviluppo di nuovi composti a base di artemisinina con proprietà anti-cancro al seno [80]. È stato scoperto che un composto ibrido che lega DHA con diaril-pirazolina attraverso il legame etereo mostra una potente attività in tre linee cellulari di cancro al seno tra cui MCF-7 / Adr (GI50 = 18 nM), MCF-7 (GI50 = 210 nM) e MDA-MB -231 (GI50 = 210 nM) [81]. L’attività inibitoria contro le cellule MCF-7 / Adr del composto è risultata 184 volte superiore a quella del DHA, indicando che il composto potrebbe essere sviluppato per essere un candidato utile per il trattamento del cancro al seno resistente ai farmaci. Durante l’esplorazione dei bersagli, è stato suggerito che la proteina tumorale controllata fosfo-traslazionalmente (phosphor-TCTP) fosse uno dei promettenti target terapeutici del DHA per il carcinoma mammario avanzato [82] (Tabella 2).

Attività antitumorale dell’artemisinina sul cancro del polmone
Il cancro del polmone ha le caratteristiche di alta incidenza, considerevole mortalità e prognosi sfavorevole. Inoltre, il suo tasso di sopravvivenza a cinque anni è rimasto al 15% a causa delle metastasi delle cellule tumorali. Studi clinici insieme a esperimenti in vivo e in vitro hanno chiarito che l’artemisinina può inibire e uccidere le cellule di cancro del polmone [87-90] (Tabella 3).

Gli studi hanno dimostrato che i valori IC50 di artemisinina e artesunato erano 769,60 e 153,54 μM sulla linea cellulare A549 [90]. AS è più potente dell’ART. L’esplorazione del meccanismo sottostante dell’artemisinina e dei suoi derivati nella lotta contro il cancro del polmone ha suggerito che Wnt / β-catenina rappresentasse un nuovo bersaglio per ART, DHA e AS nel trattamento del cancro [91]. Ruling Shen et al. ha riferito che la combinazione di onconase (Onc) e DHA può sopprimere sinergicamente la crescita e l’angiogenesi del carcinoma polmonare non a piccole cellule (NSCLC) sia in vivo che in vitro. È importante sottolineare che non sono stati osservati effetti avversi evidenti dopo il trattamento combinato di onconase e DHA [94].
Attività antitumorale dell’artemisinina sul cancro al fegato
Si pensava che l’induzione dell’apoptosi e l’arresto del ciclo cellulare fossero due dei principali meccanismi antitumorali dell’artemisinina e dei suoi derivati (Tabella 4).

L’uso combinato di inibitori dell’istone deacetilasi (HDACi) e DHA ha mostrato un effetto antineoplastico significativo sia in vivo che in vitro [95]. Dopo il trattamento combinato con DHA e HDACi, il potenziale di membrana dei mitocondri, le espressioni di Mcl-1, p-ERK, Ki61, caspasi 3 attivata e PARP erano diminuite, mentre le espressioni di p53 e Bak erano aumentate. Pertanto, l’apoptosi indotta dal DHA è stata potenziata dalla combinazione di HDACi. Inoltre, il trattamento combinato di DHA e acido farnesiltiosalicilico o l’inibitore della glutaminasi-1 968 può anche aumentare l’efficacia antitumorale del DHA nelle cellule di carcinoma epatocellulare [98, 99].
Attività antitumorale dell’artemisinina sul glioma cerebrale
Il glioma cerebrale è il tumore più letale con prognosi estremamente sfavorevole e alta penetrabilità. È stato dimostrato che l’artemisinina ei suoi derivati hanno effetti considerevoli nella lotta contro il glioma cerebrale (Tabella 5).

Finora, il trattamento combinato di DHA e temozolomide è la strategia principale per l’utilizzo di artemisinine come agenti anti-glioma. Dopo la chemioterapia combinata, l’espressione dei marcatori molecolari dell’autofagia (Beclin-1 e LC3-B) era aumentata, mentre l’espressione della caspasi-3 non è stata rilevata con alterazioni significative. I risultati hanno suggerito che il DHA può aumentare l’efficacia di inibizione tumorale della temozolomide inducendo l’autofagia [34]. AS ha anche migliorato l’effetto antiproliferativo della temozolomide sulle linee cellulari di glioblastoma U87MG e A172 [23, 104]. Recentemente è stato segnalato che il targeting funzionale di paclitaxel più liposomi di artemetere rappresenta una strategia promettente per il trattamento del glioma cerebrale invasivo [105]. Il trattamento combinato di artemetere e shRNA-VCAM-1 non solo ha soppresso in modo significativo la migrazione, l’invasione e l’espressione di MMP-2/9 e p-AKT, ma ha anche promosso l’apoptosi delle cellule U87 di glioma umano [102].
Attività antitumorale dell’artemisinina sul cancro del colon-retto
Il cancro del colon-retto è il secondo tumore maligno più comune e la quarta causa di decessi correlati al cancro in tutto il mondo. Studi recenti hanno dimostrato che i composti correlati all’artemisnina rappresentano un tipo di potenziale strategia terapeutica del cancro del colon-retto (Tabella 6).

Il trattamento con DHA può ridurre significativamente la vitalità delle cellule del cancro del colon-retto umano HCT-116 in modo dipendente dalla concentrazione e dal tempo. Il DHA ha innescato l’apoptosi nelle cellule HCT-116 tramite il percorso dipendente dai mitocondri mediato da ROS [106]. Esperimenti in vivo hanno anche dimostrato che il DHA ha una notevole attività antitumorale sul cancro del colon-retto [107]. La sintesi e la valutazione di nuovi derivati dell’artemisinina hanno scoperto che alcuni nuovi composti correlati all’artemisinina hanno anche mostrato effetti antitumorali colorettali [109].
Uno studio clinico volto a esplorare l’effetto antitumorale dell’AS ha dimostrato che l’AS ha proprietà anti-proliferative nelle cellule tumorali del colon-retto ed è generalmente ben tollerato. L’esposizione all’AS ha portato rispettivamente alla riduzione di Ki67 dell’89% e alla sovraespressione di CD31 del 79% [108].
Attività antitumorale dell’artemisinina sul cancro gastrico
L’artemisinina ei suoi derivati possono inibire la crescita del cancro gastrico sia in vitro che in vivo. ART, AS, DHA e ATM sono i più importanti composti correlati all’artemisnina che sono stati coinvolti nell’esplorazione dell’attività delle cellule di cancro antigastrico (Tabella 7). I ricercatori hanno suggerito che i composti correlati all’artemisnina potrebbero servire come un tipo di promettenti agenti cellulari antitumorali o agenti chemioterapici aggiuntivi per il trattamento del cancro gastrico.

Gli studi hanno dimostrato che il DHA può inibire in modo sorprendente la proliferazione e la formazione di colonie su tre linee cellulari di cancro gastrico (SGC-7901, BGC823 e MGC803) sopprimendo le espressioni dei marker di proliferazione (PCNA, ciclina E e ciclina D1) e su- regolazione dell’espressione di p21 e p27 [110, 111]. È stato dimostrato che l’artesunato ha un’attività delle cellule di cancro antigastrico dipendente dalla concentrazione in vitro e in vivo attraverso i meccanismi di induzione del sovraccarico di calcio, espressione di calpaina-2 up-regolazione e espressione di VEGF down-regolazione [113]. Inoltre, AS ha mostrato effetti antiproliferativi e attività che inducono l’apoptosi sulle cellule di cancro gastrico umano in modo dose-dipendente. Si pensava che la sovraespressione del fattore proapoptotico Bax, la soppressione dell’espressione del fattore antiapoptotico Bcl-2, l’attivazione di caspasi-3 e caspasi-9 e la perdita del potenziale della membrana mitocondriale fossero i potenziali meccanismi degli effetti del cancro anti-gastrico dell’AS [38].
Meccanismo antitumorale delle artemisinine
Come accennato in precedenza, l’artemisinina e i suoi derivati hanno una varietà di effetti contro il cancro sia in vitro che in vivo. La Tabella 8 riassume le principali vie di segnalazione dell’artemisinina e dei suoi derivati nel controllo del cancro.

Inibizione della proliferazione delle cellule tumorali
Nelle cellule normali, la crescita e la divisione cellulare sono controllate dall’interazione reciproca della proteina del ciclo cellulare ciclina, chinasi ciclina-dipendente (CDK) e inibitore della chinasi ciclina-dipendente (CKI) [52]. Tuttavia, le cellule tumorali hanno una forte capacità proliferativa a causa dell’amplificazione del segnale di crescita, della regolazione disabilitata del punto di test e delle mutazioni cellulari. L’artemisinina ei suoi derivati possono arrestare il ciclo cellulare nelle cellule tumorali, principalmente interferendo con la cinetica del ciclo cellulare o bloccando la via di segnalazione correlata alla proliferazione [16].
Finora, si è ritenuto che il meccanismo principale dell’artemisinina e dei suoi derivati per inibire la proliferazione delle cellule tumorali fosse strettamente associato all’effetto inibitorio selettivo dell’attività trascrizionale e ai livelli di espressione proteica delle chinasi ciclina CDK2 / 4, ciclina E, ciclina D1, e il fattore di trascrizione E2F1. Pertanto, l’artemisinina ei suoi derivati possono inibire l’attività della proteina enzimatica catalitica correlata nella proliferazione delle cellule tumorali e, successivamente, inibire la proliferazione delle cellule tumorali [86]. Sia ART che AS possono aumentare l’espressione di miR-34a in maniera dose-dipendente accompagnata dalla soppressione del gene bersaglio di miR-34a, CDK4. I risultati hanno verificato che miR-34a è un fattore fondamentale per l’attività antiproliferativa di ART e AS [83].
È stato anche dimostrato che l’attività antiproliferativa è strettamente correlata all’arresto del ciclo cellulare, che è parzialmente dipendente dall’inattivazione di Wnt / β-catenina [91]. ART, DHA e AS hanno inibito notevolmente la proliferazione delle cellule umane NSCLC A549 e H1299 arrestando il ciclo cellulare nella fase G1. Inoltre, l’ART può inibire la proliferazione nelle cellule GH3 di adenoma ipofisario di ratto attraverso percorsi dipendenti dalla caspasi [24]. Il DHA può inibire la proliferazione delle cellule endoteliali della vena ombelicale umana (HUVEC) riducendo la fosforilazione di ERK1 / 2, down-regolando l’espressione dell’mRNA e della proteina di ERK1 / 2 e inibendo la trascrizione e l’espressione proteica degli effettori a valle di ERK1 / 2 c- Fos e c-Myc [126]. AS ha mostrato significativi effetti antiproliferativi sulle cellule T CD4 + naive riducendo l’espressione della proteina di superficie cellulare CD25 (catena del recettore IL-2) e CD69 [127]. Gli studi hanno anche dimostrato che l’ART può interagire sinergicamente con altri agenti antitumorali. Ad esempio, 7P3A, composto per il 70% da 25-metossil-dammarano-3β, 12β, 20-triolo e 30% di artemisinina, ha inibito la proliferazione cellulare MDA-MB-231 e ha indotto l’arresto del ciclo cellulare attraverso la down-regolazione dell’espressione di testicoli proteasi 50 (TSP50) [128].
Induzione dell’apoptosi delle cellule tumorali
L’apoptosi gioca un ruolo fondamentale nella cura del tumore. È probabile che la perdita o l’inibizione del processo di apoptosi sia il fattore scatenante dell’insorgenza del cancro e della resistenza ai farmaci delle cellule tumorali. La via mitocondriale è una delle vie più essenziali nel processo di apoptosi cellulare. L’artemisinina reagisce con i ROS delle cellule tumorali, portando all’aumento dei ROS nelle cellule tumorali [114], all’ossidazione qualitativa della membrana mitocondriale, alla diminuzione della permeabilità e al potenziale membranoso mitocondriale. Pertanto, il citocromo ce l’AIF successivamente sono stati rilasciati nel citosol. La caspasi-8/9 viene attivata e infine la caspasi-3 attivata induce l’apoptosi cellulare [106]. L’artesunato ha indotto l’apoptosi cellulare in modo dose-dipendente aumentando i livelli di ROS e attivando p39 MAPK [115]. È stato anche verificato che l’effetto pro-apoptotico indotto dall’artemisinina è dipendente da p53 [50]. Inoltre, la diidroartemisinina può aumentare l’espressione di Bax e l’attivazione della caspasi-9. Potrebbe sopprimere Bcl-2, Bcl-xL e procaspase-3, accelerando così l’apoptosi delle cellule tumorali esofagee indotta dal DHA [55]. Inoltre, è stato dimostrato che l’apoptosi indotta dal DHA è implicata nella depolarizzazione della membrana mitocondriale, nel rilascio del citocromo c, nell’espressione delle proteine della famiglia Bcl-2 e nella frammentazione del DNA [62, 95]. Anche la down-regulation della COX-2 [19, 38], l’inibizione di HSP70 [116] e la necroptosi [57] svolgono un ruolo significativo nell’apoptosi indotta da artemisinine.
Arresto del ciclo cellulare
Le cellule tumorali hanno la proprietà di alterare il processo di differenziazione di fase da G1 a S per aumentare il numero di cellule che possono entrare nella fase S. Il DHA può arrestare le cellule tumorali in fase G0 / G1 per bloccare la crescita delle cellule tumorali.
L’esposizione al DHA ha provocato una sottoregolazione delle proteine correlate al ciclo cellulare, come la ciclina E, CDK2 e CDK4. La ciclina E, CDK2 e CDK4 sono importanti complessi responsabili della progressione delle cellule attraverso la fase G1 del ciclo cellulare e l’inizio della replicazione del DNA [55]. L’artemisinina ha arrestato marcatamente le cellule del retinoblastoma in fase G0 / G1 e S ma nessun effetto sulla fase G2 / M aumentando l’espressione di CD71. Ancora più importante, l’ART può persino arrestare il ciclo cellulare delle cellule di retinoblastoma multiresistenti [117]. La terapia combinatoria di alofuginone (HF) e artemisinina ha indotto sinergicamente l’arresto G1 / G0 delle cellule HCT116 e delle cellule MCF-7. L’up-regolazione di p21Cip1 e p27Kip1 è responsabile di questo effetto antitumorale sinergico [118].
Inibizione dell’invasione e delle metastasi delle cellule tumorali
L’effetto più essenziale delle artemisinine è quello di inibire l’invasione delle cellule tumorali e le metastasi nei tumori solidi aggressivi. Numerose ricerche hanno dimostrato che l’artemisinina ei suoi derivati possono inibire l’invasione e la metastasi della cellula tumorale senza distorsioni della linea cellulare. Ad esempio, l’AS può inibire notevolmente l’invasione e le metastasi nel NSCLC. I meccanismi principali sono in parte dovuti alla sottoregolazione dell’mRNA / proteina di MMP-2 e MMP-7, all’inibizione dell’attività dell’attivatore del plasminogeno di tipo urochinasi (u-PA), all’espressione di -proteina e -mRNA e alla soppressione di u- Attività promotore / potenziatore della PA, transattivazione di AP-1 e NF-κB [87]. Un risultato simile è stato riportato da Han et al. Hanno anche scoperto che il DHA manifesta un notevole effetto anti-metastatico attraverso l’inibizione dell’attività di NF-κB [107]. Il DHA è anche in grado di ridurre l’invasione delle cellule di glioma e le metastasi inibendo l’espressione di mRNA e proteine di ADAM17 e riducendo la fosforilazione di EGFR e AKT [103]. È stato verificato che la down-regulation di MMP-2 e MMP-9 contribuisce agli effetti anti-invasivi e anti-metastatici del DHA [110]. Un recente studio ha dimostrato che ART, DHA e AS possono inibire l’invasione e la migrazione delle cellule A549 e H1299 attraverso la via di segnalazione Wnt / β-catenina depressa [91]. Inoltre, esperimenti in vivo hanno mostrato che il DHA può inibire in modo significativo la migrazione e l’invasione delle cellule di cancro ovarico riducendo l’espressione di vWF e l’infiltrazione dei macrofagi [21].
Effetti antiangiogenici
L’angiogenesi tumorale si verifica principalmente aumentando la permeabilità vascolare, promuovendo la migrazione, la divisione e la proliferazione delle cellule staminali basali, accelerando la formazione del lume del vaso e, infine, promuovendo la crescita dei vasi sanguigni del tumore attraverso il recettore VEGF secreto dalle cellule tumorali. Pertanto, l’ostacolo di qualsiasi meccanismo di crescita delle cellule tumorali e delle cellule endoteliali, sarebbe in grado di inibire la crescita delle cellule tumorali e successivamente sopprimere la proliferazione tumorale. L’artemisinina ei suoi derivati possono ridurre l’espressione del VEGF e del recettore delle cellule endoteliali vascolari nelle cellule tumorali, in modo che la nuova angiogenesi possa essere bloccata e la proliferazione e metastasi delle cellule tumorali possano essere inibite [94]. Inoltre, il trattamento combinatorio di DHA e onconasi può aumentare la soppressione della formazione del tubo cellulare endoteliale. DHA accoppiato con cisplatino (CDDP) ha dimostrato di esibire un effetto anti-angiogenico sopprimendo l’espressione delle proteine correlate alla vascolarizzazione HIF-1α e VEGF sia in vivo che in vitro [119]. L’AS combinato con il captopril ha anche mostrato effetti sinergici sull’inibizione della formazione e della crescita di nuovi vasi [129].
Reazioni al danno ossidativo
Le cellule tumorali richiedono più ferro per mantenere la loro rapida proliferazione. È opinione condivisa che i composti correlati all’artemisinina esercitino le loro attività antitumorali attraverso reazioni di danno ossidativo. Il DHA ha mostrato un meccanismo antitumorale indipendente dai ROS abbassando il livello di TfR1 sulla superficie cellulare attraverso un percorso endocitico inaspettato, portando al declino dell’assorbimento di ferro mediato da TfR1 e alla carenza di riserve di ferro cellulare [120]. DHA, AS, dimero derivato dall’artemisinina ART-838 e il nuovo sesquiterpene lattone naturale con un gruppo endoperossido (tehranolide) hanno dimostrato di essere in grado di inibire la crescita delle cellule tumorali aumentando i livelli intracellulari di ROS [64, 115, 130, 131].
Migliora la sensibilità della chemioterapia e della radiosensibilità
Durante il trattamento del cancro, i farmaci chemioterapici a volte possono stimolare le cellule normali a produrre sostanze chimiche che potrebbero accelerare la crescita delle cellule tumorali. Pertanto, le cellule tumorali possono diventare gradualmente resistenti ai farmaci chemioterapici. Mutazioni somatiche o delezioni omozigoti dei geni DPC4 / SMAD4, TP53 e P16 / CDKN2A sono state chiarite per avere una correlazione con le risposte ai farmaci in vitro. L’attivazione dei percorsi MAPK da parte di TGFβ è spesso in modo indipendente da DPC-4. L’attivazione di DPC4 ha portato anche alla down-regulation di P15 / CDKN1B e alla up-regulation di CDCA4 e CDC2L6 [122]. Artesunate è stato indicato per essere in grado di compromettere la riparazione dei DSB del DNA nelle cellule di cancro ovarico attraverso la down-regolazione della formazione di foci RAD51 e la riparazione di ricombinazione omologa (HRR). Pertanto, RAD51 è stato identificato come un componente chiave per lo sviluppo della SA come agente sensibilizzante nella chemioterapia [121]. Inoltre, l’AS può anche aumentare la sensibilità radio delle cellule tumorali, sebbene il meccanismo fosse complicato poiché erano coinvolti più di 200 geni. Le esposizioni di AS hanno notevolmente influenzato più percorsi tra cui il trasporto dell’RNA, lo spliceosoma, la degradazione dell’RNA, la segnalazione di p53 e MAPK [123]. Inoltre, l’AS ha suscitato un effetto radio-sensibilizzante riducendo la sopravvivenza della proteina dell’apoptosi [23]. Alcune ricerche hanno dimostrato che NESSUNA produzione è associata alla radiosensibilità. AS ha mostrato una potenziale capacità di migliorare la radiosensibilità delle cellule A549 di NSCLC umano aumentando il livello di NO all’interno delle cellule A549 irradiate [42].
Regolazione del microambiente tumorale
Nel microambiente tumorale, si ritiene che i macrofagi associati al tumore (TAM) abbiano molteplici funzioni di promozione della crescita e delle metastasi tumorali, come la secrezione di fattori di crescita e proteasi, la promozione dell’angiogenesi e l’inibizione dell’immunità adattativa. Il DHA può inibire l’infiltrazione dei macrofagi nel tumore in situ e nelle metastasi, indicando un nuovo meccanismo dell’attività anti-cancro dei composti correlati all’artemisinina [21].
Le cellule T regolatorie (Treg) sono un membro cardine del microambiente tumorale, che può portare al silenzio della risposta immunitaria. L’accumulo di cellule Treg nei tessuti tumorali precoci è associato allo sviluppo del tumore e alla prognosi infausta. Nei modelli murini di xenotrapianto di cancro al seno, l’artemisinina ha ridotto notevolmente il numero di Treg nella matrice tumorale e ha aumentato la proporzione di IFN-γ / I-4 nel supernatante delle cellule della milza [124], portando all’inibizione del microambiente immunitario su sviluppo del tumore. Artemether può potenziare l’ipersensibilità di tipo ritardato e l’anticorpo della coagulazione nei topi normali, ridurre le cellule CD4 + CD25 + Foxp3 + Treg nei topi affetti da tumore, aumentare la produzione di IL-4 e IFN-γ [132]. Risultati simili sono stati trovati da Noori e Hassan [133]. Durante la loro ricerca hanno anche rilevato la diminuzione delle cellule CD4 +, CD25 +, Foxp3 +, Treg, la promozione dell’IFN-γ e l’inibizione della secrezione di IL-4 che può innescare il passaggio Th2 alle vie Th1. Il DHA può ridurre la PGE2, inibire la produzione di NO e le citochine (IL-1-b, IL-6, TNF-α, VEGF) per regolare le funzioni immunitarie [125]. Queste ricerche hanno documentato che la regolazione del microambiente tumorale è uno dei meccanismi molecolari dell’attività antitumorale dei composti correlati all’artemisinina.
Studi clinici di artemisinine come farmaci antitumorali
Hosoya K e collaboratori della Ohio State University hanno valutato la tossicità clinica e l’attività dell’artemisinina nei cani con tumori spontanei mediante somministrazione orale [134]. Nel loro studio, 24 cani sono stati separati in due gruppi in modo casuale e ogni gruppo ha ricevuto una dose continua bassa (3 mg / kg ogni 24 h) o una dose elevata intermittente (tre dosi di 45 mg / kg ogni 6 h ripetute ogni 1 settimana ) di artemisinina per os per 21 giorni. Tuttavia, solo l’11% del gruppo a basso dosaggio e il 29% del gruppo ad alto dosaggio sono stati osservati con anoressia. Entrambi i gruppi sono stati ben tollerati con artemisinina nei cani tramite somministrazione orale. Sfortunatamente, entrambi i gruppi hanno mostrato una bassa biodisponibilità, quindi la somministrazione parenterale dovrebbe essere presa in considerazione per ulteriori studi. Inoltre, è obbligato a sviluppare nuovi composti correlati all’artemisinina con una buona biodisponibilità e proprietà antitumorali desiderabili.
In generale, gli studi clinici sulle artemisinine si concentrano principalmente sull’artesunato. Un gruppo dell’Università di Göteborg ha innanzitutto caratterizzato la farmacocinetica di popolazione di AS e DHA in pazienti con carcinoma mammario metastatico e la relazione tra le concentrazioni salivari e plasmatiche di DHA durante la somministrazione orale giornaliera di AS a lungo termine (> 3 settimane) [135]. Il loro studio ha chiarito che il campionamento della saliva potrebbe essere utilizzato nelle indagini farmacocinetiche per offrire un’alternativa di campionamento più economica poiché le concentrazioni di farmaco nella saliva sono in equilibrio con quelle nel sangue arterioso. Inoltre, è stato suggerito che il metabolismo dell’AS fosse autoinduzione. Dopo lunga durata orale quotidiana AS, è stato osservato un aumento del 24,9% della clearance apparente di eliminazione del DHA. Nel 2015, Sanjeev Krishna e colleghi hanno anche riportato la loro ricerca clinica sulla proprietà antitumorale e sulla tollerabilità della SA orale nel cancro del colon-retto [108]. Il 67% dei pazienti nel gruppo AS (n = 12) e il 55% dei pazienti nel gruppo placebo (n = 11) hanno sviluppato un’apoptosi cellulare> 7%. Ki67, che si ritiene essere un biomarcatore significativo della prognosi nel cancro del colon-retto, è risultato diminuito dopo il trattamento orale di 200 mg al giorno di AS, mentre l’espressione del CD31 è stata aumentata. L’analisi bayesiana ha mostrato che le probabilità dell’effetto del trattamento AS riducendo Ki67 e aumentando l’espressione di CD31 erano rispettivamente 0,89 e 0,79. I risultati hanno indicato che l’effetto antitumorale dell’AS era anche correlato agli esiti immunoistochimici. Durante questo studio, solo un paziente trattato con AS ha sviluppato un cancro del colon-retto ricorrente, mentre sei pazienti trattati con placebo sono stati osservati con un cancro del colon-retto ricorrente. Tuttavia, sono stati osservati due eventi avversi possibilmente correlati alla SA, che ci hanno spinto a fare studi clinici più completi con composti correlati all’artemisinina per completare le informazioni di questo tipo per promettenti agenti antitumorali. Al fine di determinare la dose massima tollerata (MTD) e la tossicità dose-limitante (DLT) di AS per via endovenosa, Deeken et al. ha eseguito uno studio di fase I per esplorare l’utilità dell’AS per combattere le neoplasie degli organi solidi [136]. 19 pazienti sono stati arruolati nello studio e 18 di loro erano valutabili per la tossicità, mentre 15 di loro erano valutabili per la risposta di efficacia. Al dosaggio di 25 mg / kg, entrambi i due pazienti hanno manifestato DLT, mentre solo uno dei sei pazienti al dosaggio di 12 e 18 mg / kg soffriva di DLT. Quindi, l’MTD è risultato essere 18 mg / kg utilizzando un giorno 1 e 8 su una somministrazione push endovenosa con ciclo di 21 giorni. Sono stati osservati diversi tipi di tossicità, tra cui anemia, nausea / vomito, stanchezza e anoressia, che erano stati segnalati in precedenza con l’uso di AS nel trattamento della malaria. Inoltre, in una percentuale significativa dei pazienti sono stati osservati anche disturbi della funzionalità epatica e degli elettroliti. Pertanto, la premedicazione mirata a prevenire la nausea o le reazioni di ipersensibilità dovrebbe essere presa in considerazione nelle applicazioni future.
Alcune letterature precedenti hanno dimostrato che le artemisinine potrebbero avere effetti avversi legati al sistema uditivo e vestibolare [137-139]. Considerando queste preoccupazioni, è stata eseguita una valutazione audiologica della SA basata sull’assunzione orale di 4 settimane di AS in dosi fino a 200 mg al giorno su 23 pazienti di sesso femminile con carcinoma mammario metastatico o localmente avanzato [140]. Auspicabilmente, tutti i pazienti coinvolti nei trattamenti sono stati ben tollerati considerando la funzione neuro-audi
Nuove Direzioni
Regolazione immunitaria delle artemisnine
L’immunoterapia dei tumori sta diventando una delle principali strategie terapeutiche del trattamento del cancro. Indagini più approfondite ci hanno mostrato che le artemisinine causano anche una risposta immunitaria alle cellule tumorali [7, 10, 40]. Cinque tipi di cellule immunitarie, comprese le cellule DC, CIK, cellule natural killer (cellule NK), cellule T natural killer (cellule NKT) e cellule CD3AK costituiscono la linea di difesa generale per il trattamento del cancro. Le cellule NK sono un tipo di cellule del sistema immunitario innato, che possono uccidere le cellule staminali tumorali stimolando l’esocitosi dei granuli litici per prevenire la recidiva e le metastasi del cancro [141]. Quindi indurre l’esocitosi dei granuli litici delle cellule NK è una strategia promettente per sviluppare una terapia antitumorale mirata [142]. Youn Kyung Houh e collaboratori hanno prima riferito che l’artemisinina ha mostrato un potente effetto antitumorale attivando le cellule NK [143], che forniscono una nuova prospettiva per l’esplorazione del meccanismo di azione antitumorale delle artemisinine. Lo studio ha dimostrato che l’ART può potenziare l’attività citolitica delle cellule NK in maniera dose-dipendente, mentre la stimolazione dell’esocitosi dei granuli è stata evidenziata dalla sovraregolazione dell’espressione delle cellule NK CD107ain. La fosforilazione di Vav-1, una molecola di segnalazione a valle per i recettori attivatori di NK, è stata rapidamente up-regolata seguita dall’aumento della fosforilazione di ERK 1/2. La ricerca ha evidenziato che l’artemisinina può promuovere la degranulazione delle cellule NK attraverso la stimolazione delle molecole di segnalazione del recettore attivatore NK, determinando così la potente attività antitumorale dell’artemisinina.
Con lo sviluppo dell’immunologia, l’immunoterapia dei tumori sta per rivendicare un posto nel pantheon terapeutico dell’oncologia, accanto alla chirurgia, alla chemioterapia e alla radioterapia [144]. Quindi, un’ulteriore esplorazione dei ruoli delle artemisinine nell’immunoterapia dei tumori potrebbe espandere la nostra comprensione delle artemisnine.
L’attivatore dell’artemisinina
È comunemente accettato che il ponte endoperossido delle artemisinine sia vitale per la sua attività antitumorale, mentre il ferro ferroso (sia in forma ferrosa libera che in forma eme) era ritenuto il principale attivatore dell’attività antitumorale delle artemisnine [145]. Tuttavia, l’attivatore esatto è ancora oggetto di controversia.
Negli anni, è stato proposto che il ferro ferroso libero fosse il principale attivatore dell’artemisinina [6, 8, 26, 29]. Tuttavia, presentando un’analisi proteomica chimica imparziale, Wang et al. hanno sottolineato che l’attivazione dell’artemisinina è prevalentemente dipendente dall’eme [29, 146]. Al fine di identificare gli obiettivi dell’artemisnina, è stato progettato e sintetizzato un analogo dell’artemisinina marcato con alchino accoppiato con biotina (denominato AP1). Durante lo studio, hanno trovato 124 bersagli dell’artemisinina nel parassita, ma hanno anche chiarito che l’artemisinina può essere attivata direttamente dall’eme. L’API da sola non può legarsi all’ornitina aminotransferasi (OAT), che è coinvolta nelle vie metaboliche chiave del parassita. Il legame API richiede l’esposizione dell’emina e può essere potenziato dall’acido L-ascorbico (Vc)) Na2S2O4 o dai reagenti glutatione (GSH) che possono ridurre l’emina a emina [147], mentre l’aggiunta di ferro ferroso non ha effetti su API-OAT rilegatura. È stata quindi sintetizzata una nuova sonda di attività a base di artemisinina ART-TPP-Alk. 321 e 860 proteine che possono legarsi covalentemente all’artemisnina nelle cellule HCT116 sono state individuate utilizzando rispettivamente AP1 e ART-TPP-Alk. La proteomica chimica e gli esperimenti sulla vitalità cellulare hanno dimostrato che l’eme libero potrebbe attivare efficacemente l’ART, mentre il ferro ferroso libero ha effetti minimi sull’attivazione dell’ART e la modulazione dell’eme endogeno potrebbe anche influenzare l’attività antitumorale dell’ART. I risultati hanno convalidato che l’eme libero è l’attivatore chiave nelle cellule tumorali [148]. Sulla base delle ricerche, sono stati valutati gli effetti antitumorali dell’artemisinina combinata con un precursore della sintesi dell’eme acido ammino levulinico (ALA) utilizzato clinicamente. Auspicabile, la citotossicità specifica dell’ART nei confronti delle cellule di cancro del colon-retto (CRC) può essere migliorata con l’aggiunta di ALA [149]. I loro risultati ci hanno incoraggiato a intraprendere il meccanismo delle azioni a partire dall’attivatore e trovare un nuovo composto antitumorale correlato all’artemisinina che può agire con l’attivatore.
Nanoplatform migliora l’efficacia delle artemisinine
Sebbene ci siano così tante ricerche che indicano che i composti correlati all’artemisinina hanno potenti proprietà antitumorali in virtù dei loro pochi effetti avversi e della maggiore tolleranza da parte dei pazienti [150], l’applicazione clinica delle artemisnine era difficile da trovare. Il principale ostacolo delle artemisnine per applicazioni cliniche era la scarsa solubilità in acqua e la bassa biodisponibilità [136], che portavano alla necessità di un alto dosaggio di artemisnine per maggiori effetti antitumorali. Sfortunatamente, con l’aumento dell’uso di artemisnine, i loro effetti collaterali divennero solitamente più notevoli [151]. Peggio ancora, come un tipo di farmaci terapeutici indotti dai radicali, è difficile per le artemisinine ottenere un trattamento locale [152]. Pertanto, l’urgente necessità è trovare un potenziale metodo per affrontare questi problemi. Le nanoparticelle, uno strumento chiave nella terapia antitumorale mirata, possono ottenere una distribuzione mirata al farmaco e aumentare la biodisponibilità del farmaco per migliorare l’efficacia del trattamento [153].
Negli ultimi anni, un numero crescente di ricerche si è concentrato sullo sviluppo di nanoplatforme a base di artemisinina per promuovere l’efficienza terapeutica del trattamento del cancro [11, 59, 79, 152, 154–156]. Zhang et al. recentemente ha sintetizzato due tipi di nanoplatform da applicare nel trattamento del cancro a base di artemisinina [157, 158]. Un tipo di nanoplatform che hanno sviluppato era una nanoplatform sensibile alla luce visibile (HA-TiO2-IONPs / ART). TiO2 è stato innestato con Fe3O4 per formare nanocompositi magnetici di titania (TiO2-IONP) per fungere da fotocatalizzatori sensibili alla luce visibile [159]. La polietilenimina (PEI) è stata innestata su TiO2-IONP mediante legame di coordinazione Fe-N. Collegando ialuronico ai nanomateriali (HA-TiO2-IONP), la biocompatibilità, la stabilità di dispersione e la capacità citofagica di TiO2-IONP sono state migliorate. L’artemisinina è stata infine caricata sul supporto per ottenere la nanoplatform di consegna finale (HA-TiO2-IONPs / ART). Come parte principale della nanoplatform, TiO2-IONP può assorbire la luce visibile per generare ROS dalla terapia fotodinamica del tumore (PDT). Inoltre, TiO2-IONP può essere degradato in ambienti acidi per rilasciare ferro ferroso. Poiché il sito del tumore è un ambiente leggermente acido [160], TiO2-IONP rilascerà il ferro ferroso quando raggiungono il sito del tumore bersaglio. Pertanto, l’artemisinina e il ferro ferroso possono essere somministrati simultaneamente alle cellule tumorali. Sono stati condotti esperimenti in vitro e in vivo per valutare l’effetto antitumorale di HA-TiO2-IONPs / ART. Questo sistema di co-somministrazione di ferro ferroso e artemisinina si è infine rivelato i promettenti agenti antitumorali. Un’altra nanoplatform che hanno sviluppato era simile a HA-TiO2-IONPs / ART. Fe3O4 mesoporoso, una sorta di campo magnetico alternato (AMF) e materiale che risponde al tumore, è stato utilizzato per incapsulare l’artemisinina. Quindi, la superficie esterna di mFe3O4 è stata ricoperta con HA (HA-mFe3O4 / ART). HA-mFe3O4 / ART può portare ART e ferro ferroso nelle cellule MCF-7 e rilasciare Fe2 + e ART nello stesso sito. Inoltre, l’irradiazione di AMF potrebbe aumentare l’attività antitumorale di HA-mFe3O4 / ART convertendo l’onda elettromagnetica in calore per la terapia termica del tumore e promuovendo la generazione di ROS per la PDT tumorale [157]. Allo stesso modo, sulla base del meccanismo di apoptosi cellulare mediata da ROS, è stato scoperto un nuovo sistema di nanofarmaci che genera ROS mediato da Fe2 + a base di artemisinina con elevata capacità di carico ART, degradabilità acida e biocompatibilità [3]. Il sistema intelligente del nanodrug può essere accumulato in modo efficiente nel sito del tumore. Pertanto, il microambiente debole del tumore acido potrebbe accelerare il rilascio di Fe2 + per produrre ROS. Inoltre, una luce nel vicino infrarosso potrebbe aumentare la temperatura locale del tumore per accelerare la generazione di ROS. Questa generazione di ROS localizzata è un modo promettente per combattere le cellule maligne e il tumore solido. Lidong Liu e colleghi hanno sviluppato un diverso tipo di nanoplatform NiO mesoporosa caricata con artemisinina basata su nanoparticelle mesoporose di NiO (mNiO) e complessi di terbio (Tb) come veicolo [152]. L’mNiO, che è un nuovo materiale sensibile al pH, è stabile a pH fisiologico 7,4. Tuttavia, le cellule tumorali si sono sempre rivelate acide. Pertanto, in microambienti tumorali, mNiO si degrada per rilasciare Ni2 + che potrebbe portare alla scissione del ponte endoperossido di ART e produrre radicali liberi per uccidere le cellule tumorali. È interessante notare che mNiO può anche essere utilizzato come agente di conversione fototermica per la terapia fototermica del cancro (PTT) grazie alla sua notevole assorbanza nel vicino infrarosso. Le prestazioni eccezionali sia nella risonanza magnetica pesata in T2 (r2 = 6,30 (mg mL − 1) −1 s − 1) che nell’imaging luminescente hanno suggerito che questa nanoplatforma a base di farmaci naturali può servire come strategia terapeutica sinergica per il trattamento del cancro. Anche gli esperimenti in vivo e in vitro hanno confermato le buone prestazioni dell’agente. Altre ricerche hanno anche dimostrato che i sistemi di rilascio di nanoparticelle a base di artemisinina potrebbero migliorare in particolare l’efficienza antitumorale dei composti correlati all’artemisinina [161, 162]. Pertanto, lo sviluppo di nanoplatform a base di artemisinina è un modo efficace per trovare potenti derivati dell’artemisinina con una buona biodisponibilità e proprietà di targeting.
Composti ibridi sintetici a base di artemisinina
La terapia combinatoria è ampiamente utilizzata nel trattamento del cancro per superare la resistenza ai farmaci. Tuttavia, è una sfida scegliere i farmaci e le dosi adeguate per la terapia combinatoria a causa della differenza nelle proprietà chimiche e farmacocinetiche dei farmaci. Le interazioni farmaco-farmaco che potrebbero esistere sono anche le preoccupazioni che dovremmo prendere in considerazione. Inoltre, la terapia combinatoria ha sempre bisogno di accelerare più soldi, il che causerà un onere aggiuntivo per i pazienti [163]. Pertanto, l’ibridazione di prodotti naturali bioattivi è diventata un approccio promettente per superare i problemi di cui sopra e ottenere nuovi agenti antitumorali specifici [74, 163, 164]. Due o più frammenti di prodotti naturali si combinano tra loro portando a una nuova struttura che possiede con migliori attività biologiche tramite legami covalenti [5, 31, 74, 165, 166].
Annemarie Ackermann e colleghi hanno collegato l’artesunato con acido betulinico (BETA) per generare un composto ibrido 212A con desiderabile attività anti-glioma [167]. Rispetto ai suoi composti originari AS e BETA, 212A era più efficiente. Degno di nota, la migrazione delle cellule di glioma può essere soppressa dall’ibrido 212A. Tuttavia, la sola BETA non ha quasi alcun effetto sulla migrazione del glioma. Sono stati sintetizzati anche coniugati di DHA e alcuni agenti chemioterapici in commercio, inclusi clorambucile, melfalan, flutamide, aminoglutetimide e doxifluridina per valutare le loro attività antitumorali delle cellule di cancro ovarico [168]. Tra tutti i coniugati, l’artemisinina e il composto ibrido di melfalan (AS4) hanno mostrato il miglior potenziale nella lotta contro il cancro ovarico con minore citotossicità per le cellule normali. L’attività inibitoria di AS4 ha più potenza di DHA e melfalan, poiché i valori IC50 di AS4 sono 0,86 μM per le cellule A2780 e 0,83 μM per le cellule OVCAR3, mentre i valori IC50 di DHA sono 4,75 μM per le cellule A2780 e 5,63 μM per le cellule OVCAR3 e i valori IC50 di melfalan sono 23,18 μM per le cellule A2780 e 11,61 μM per le cellule OVCAR3, rispettivamente. AS4 può indurre selettivamente l’apoptosi delle cellule di cancro ovarico umano, aumentando l’espressione di caspasi 3/7 e PARP, down-regolando l’espressione di Bcl-2. AKT totale ridotto e defosforilazione di AKT, mTOR ed ERK hanno indicato che AS4 potrebbe portare all’inattivazione della via PI3 K / AKT e MAPK / ERK in modo dose-dipendente. Inoltre, AS4 può inibire la progressione del ciclo cellulare nella fase S regolando verso il basso le espressioni di CDK e cicline e aumentando l’espressione dell’inibitore CDK p21 [168]. È stato scoperto che nove nuove molecole ibride di artemisinina e frazioni degli acidi biliari hanno il potenziale per combattere le cellule leucemiche CCRF-CEM sensibili ai farmaci in un intervallo IC50 compreso tra 0,019 e 0,192 μM e la linea secondaria di leucemia multiresistente CEM / ADR5000 in un Intervallo IC50 di 0,345–7,159 μM, rispettivamente [31].
Soprattutto, i composti ibridi sintetici a base di artemisinina possono aumentare il potenziale biologico delle artemisinine e migliorare l’efficienza chemioterapica del trattamento. L’approccio ibrido apre la possibilità di combinazione di praticamente qualsiasi struttura molecolare ed espande l’ambito di esplorazione degli agenti chemioterapici [167].
Sviluppo futuro di artemisinine come farmaci antitumorali
Il tumore, una delle principali malattie che minaccia gravemente la salute umana, è sempre stato al centro del campo medico. Negli ultimi anni sono stati approvati molti nuovi farmaci chemioterapici e la tecnologia radioterapica è sempre più matura. Tuttavia, la sensibilità delle cellule tumorali è diminuita. Peggio ancora, poiché i chemioterapici più comuni hanno ancora molti effetti collaterali indesiderati, molti pazienti non possono nemmeno continuare il trattamento. Pertanto, la richiesta di nuovi farmaci con elevata attività antitumorale e bassa incidenza di effetti avversi rimane una questione prevalente in oncologia clinica.
Come descritto sopra, anche l’artemisinina ed i suoi derivati, il farmaco di prima linea della malaria, hanno manifestato notevoli effetti sul trattamento dei tumori. Le artemisinine possono invertire la resistenza chemioterapica delle cellule tumorali con bassa citotossicità nelle cellule normali. Quindi, le cellule tumorali possono diventare nuovamente sensibili ai farmaci chemioterapici e l’effetto antitumorale sarà aumentato. Sebbene siano stati eseguiti numerosi esperimenti su animali e test di laboratorio per esplorare l’effetto antitumorale delle artemisinine, la nostra comprensione delle artemisnine è limitata. Al fine di sviluppare le artemisinine come un tipo di agenti antitumorali ad alta potenza e bassa tossicità e fare pieno uso delle artemisinine, dovrebbero essere fatte ulteriori ricerche e abbiamo una lunga strada da percorrere.
Ecco alcune questioni chiave che dobbiamo esplorare:
- Il meccanismo di danno selettivo dell’artemisinina alle cellule tumorali rimane sfuggente e il meccanismo tossico della maggior parte dei derivati dell’artemisinina sulle cellule normali necessita ancora di ulteriori studi.
- È difficile per l’artemisinina raggiungere l’obiettivo antitumorale della sola terapia clinica. La combinazione di artemisinina e suoi derivati con farmaci chemioterapici tradizionali può aumentare in modo significativo l’effetto anti-cancro di altri farmaci chemioterapici senza evidenti effetti collaterali. In particolare, nelle cellule tumorali con resistenza ai farmaci chemioterapici, l’artemisinina ha mostrato una significativa attività antitumorale, suggerendo che l’artemisinina ha il potenziale per essere un farmaco chemioterapico combinato per ridurre la resistenza delle cellule tumorali con i farmaci chemioterapici tradizionali. Tuttavia, combinazioni e dosi corrette sono un problema difficile da risolvere.
- Finora, la maggior parte delle ricerche sul meccanismo anti-cancro delle artemisinine si sono concentrate principalmente su artemisinina, diidroartemisinina e altri monomeri semplici. Le ricerche sul meccanismo anti-cancro dei derivati dell’artemisinina e dei loro polimeri sono ancora un importante punto di svolta, e il rapporto struttura-attività dell’attività antitumorale dei derivati dell’artemisinina deve ancora essere studiato.
- Molti studi hanno dimostrato che diversi composti di artemisinina hanno diversi effetti anti-cancro, indicando che l’attività antitumorale delle artemisinine ha selettività. Le artemisinine potrebbero causare attività antitumorale nelle cellule tumorali attraverso bersagli specifici. Finora, non è stato scoperto alcun bersaglio esatto delle artemisinine correlate all’antitumore. Una recente ricerca ha scoperto che 860 proteine possono legarsi con l’ART, questo ci permette di trovare bersagli più precisi delle artemisnine [148].
- Le artemisinine non solo hanno un effetto di uccisione selettiva sulle cellule tumorali, ma hanno anche la capacità di regolare il microambiente tumorale, l’anti-angiogenesi e inibire le metastasi delle cellule tumorali. Tuttavia, il relativo meccanismo molecolare non ha una conclusione sistemica e chiara. Pertanto, nella futura ricerca sui farmaci antitumorali, sarà necessario esplorare il meccanismo dell’artemisinina per uccidere le cellule tumorali e per regolare il microambiente. L’identificazione dell’obiettivo diretto delle artemisinine e la creazione di una ragionevole piattaforma di screening dei farmaci forniranno una base di ricerca essenziale per lo sviluppo di nuovi farmaci antitumorali che abbiano valore clinico.


